In der Phase 2 FIGHT-Studie zeigte Bemarituzumab (Bema) + mFOLFOX6 eine vielversprechende Überlebensverbesserung bei FGFR2b-überexprimierenden, HER2-negativen Tumoren.
“Bemarituzumab (BEMA) plus chemotherapy for advanced or metastatic FGFR2b-overexpressing gastric or gastroesophageal junction cancer (G/GEJC): FORTITUDE-101 phase 3 study results” – Rha et al.
Nun wurden neue Ergebnisse der Phase 3 FORTITUDE-101-Studie vorgestellt.
Ergebnisse:
Patient:innen mit unbehandelten (ein Zyklus mFOLFOX6 vor Randomisierung erlaubt) lokal inoperablen oder metastasierten Magen- oder GEJ (gastroösophagealen Übergang) Adenokarzinomen, die HER2-negativ waren und eine Überexpression von FGFR2B (≥ 10 % positive Tumorzellen) zeigten, wurden in zwei Gruppen randomisiert: Bemarituzumab (15mg/kg Q2W + 7,5mg/kg an Tag 8) + mFOLFOX6 (n=159) oder Placebo + mFOLFOX6 (n=165).
Wirksamkeit:
Die Behandlung mit Bemarituzumab + Chemotherapie zeigte ein signifikant längeres Gesamtüberleben mit 17,9 Monaten im Vergleich zu 12,5 Monaten mit Placebo bei einem medianen Follow-Up von 11,8 Monaten (Abbildung 1).
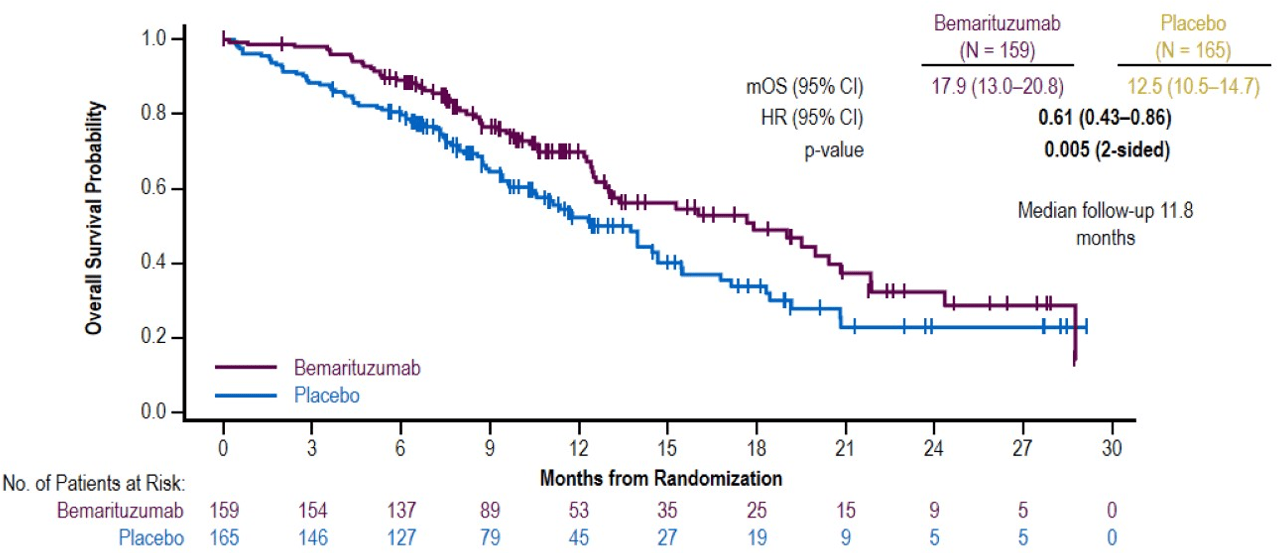
Abbildung 1: Mittleres Gesamtüberleben für Bemarituzumab vs. Placebo in Monaten.
Die Subgruppenanalyse zeigte einen durchgehenden Vorteil bei Gesamtüberleben nach Bemarituzumab Therapie vs. Placebo unabhängig von Altersgruppe, Geschlecht, Region, oder ECOG-Score.
Bemarituzumab + Chemotherapie führte zu einem signifikant längeren progressionsfreiem Überleben mit 8,6 Monaten im Vergleich zu 6,7 Monaten mit Placebo bei einem medianen Follow-Up von 11,1 Monaten. Es wurde kein Unterschied im objektiven Ansprechen auf die Behandlung beobachtet (Bemarituzumab: 45,9% vs. Placebo: 44,8%).
Der initiale Vorteil von Bemarituzumab + Chemotherapie für das Gesamtüberleben schwächte sich in einer nachfolgenden deskriptiven Follow-Up Analyse von 19,4 Monaten ab (Bemarituzumab: 14,5 Monate vs. Placebo: 13,2 Monate).
Verträglichkeit:
Die häufigsten unerwünschten Nebenwirkungen nach Behandlung mit Bemarituzumab + Chemotherapie (n=275, Placebo: n=267) waren verminderte Sehstärke, punktförmige Keratitis, Anämie, Neutropenie, Übelkeit, Hornhautepitheldefekte, und trockene Augen. Unerwünschte Ereignisse, die das Auge und die Hornhaut betrafen, erschienen verspätet und lösten sich graduell, während sich die Sehstärke schnell verbesserte.
Die häufigsten höhergradigen Nebenwirkungen (≥Grad 3) involvierten die Augen und Hornhaut, traten nach ~24 Wochen auf, und führten zu verminderter Sehstärke. Nach einem Follow-Up von ≥17 Wochen waren 90% der hochgradigen Hornhautereignisse abgeklungen.
Fazit:
Bemarituzumab + Chemotherapie zeigte einen klinisch relevanten Überlebensvorteil gegenüber Placebo, der sich nach längerer Nachbeobachtungsdauer verringerte. Unerwünschte Ereignisse betrafen hauptsächlich die Augen und Hornhaut, waren aber vorübergehend und reversibel. Diese Ergebnisse zu Effektivität und Verträglichkeit werden zusammen mit der FORTITUDE-102-Studie die Behandlung mit Bemarituzumab von Patient:innen mit Magen- oder GEJ-Adenokarzinomen weiter charakterisieren.
Slides können Sie
hier herunterladen.


