Beim ASCO 2025 wurden die ersten Phase 3 Daten von Tarlatamab vs. Chemotherapie in der Zweitlinie des SCLC präsentiert.
Tarlatamab nach platin-basierter Chemotherapie im SCLC
Tarlatamab versus chemotherapy (CTx) as second-line (2L) treatment for small cell lung cancer (SCLC): Primary analysis of Ph3 DeLLphi-304. - Rudin et al. LBA8008
Die Phase 3 Studie DeLLphi-304 untersuchte den Einsatz von Tarlatamab, einem bispezifischen T-Zell-aktivierenden Antikörper gegen DLL3, im Vergleich zur Standard-Chemotherapie (Topotecan, Lurbinectedin oder Amrubicin) in der Zweitlinientherapie bei Patient:innen mit kleinzelligem Lungenkarzinom (SCLC), die während oder nach einer platin-basierten Chemotherapie progredient waren.
Ergebnisse:
Das mediane OS betrug 13,6 Monate in der Tarlatamab-Gruppe (n = 254) gegenüber 8,3 Monaten in der Chemotherapie-Gruppe (n = 255). Dies entspricht einer Hazard Ratio von 0,60 (95 %-Konfidenzintervall: 0,47–0,77) zugunsten von Tarlatamab, mit einem signifikanten p-Wert von < 0,001 (siehe Abbildung 1). Die Studie erreichte damit ihren primären Endpunkt. Tarlatamab zeigte einen Überlebensvorteil in allen präspezifizierten Subgruppen (z.B. Vorhandsein von Hirnmetastasen ja/nein, chemotherapiefreies Intervall ≤/≥ 90 Tagen).
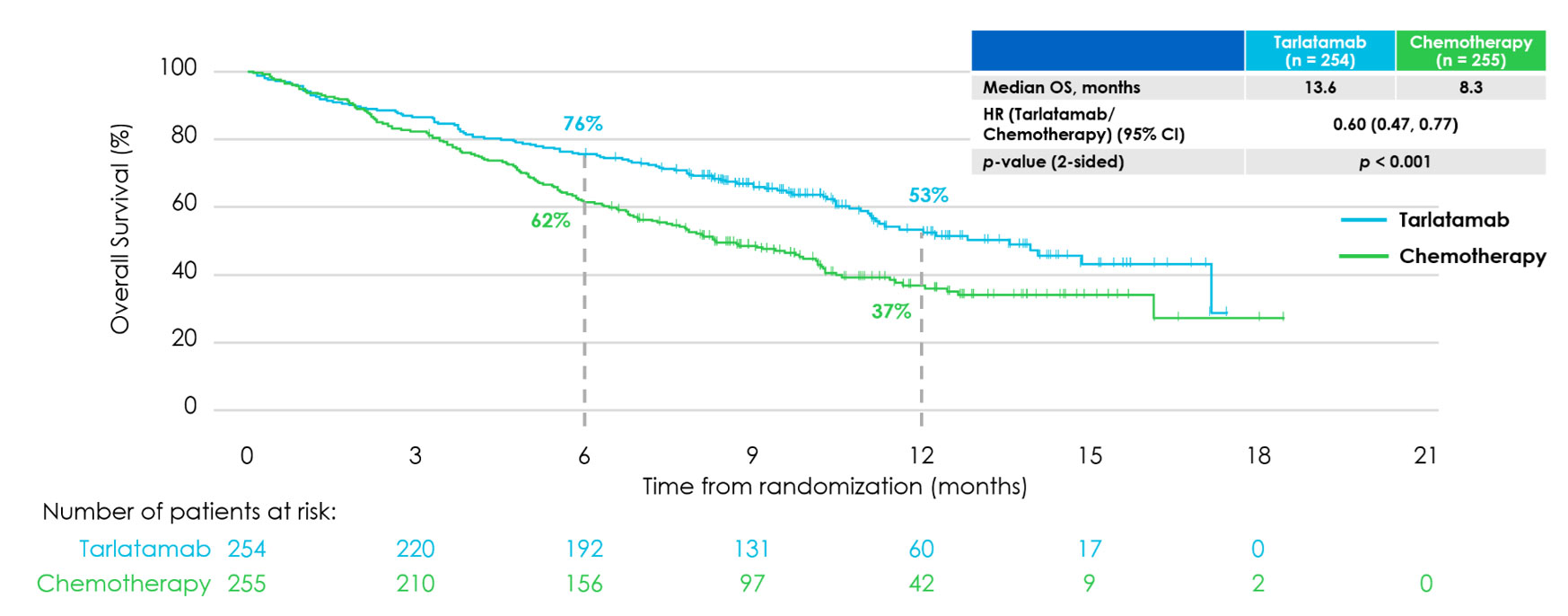
Abbildung 1 Gesamtüberleben von Tarlatamab vs. Chemotherapie
In der DeLLphi-304-Studie zeigte Tarlatamab gegenüber der Chemotherapie auch ein überlegenes progressionsfreies Überleben (mPFS: 4,2 vs. 3,7 Monate; HR: 0,71; p = 0,002). Die objektive Ansprechrate lag unter Tarlatamab bei 35 % (95 % CI: 29–41) im Vergleich zu 20 % (95 % CI: 16–26) unter Chemotherapie, mit einer medianen Dauer des Ansprechens von 6,9 versus 5,5 Monaten. Zum Zeitpunkt des Daten-Cut-offs wiesen 47 % der mit Tarlatamab behandelten Patient:innen ein persistierendes Ansprechen auf, im Vergleich zu 15 % der Patient:innen im Chemotherapie-Arm.
Verträglichkeit:
Die Inzidenz therapieassoziierter Nebenwirkungen ≥ Grad 3 lag unter Tarlatamab bei 27 % gegenüber 62 % unter Chemotherapie; auch dosisreduzierende oder dosisunterbrechende Nebenwirkungen traten weniger häufig auf (19 % vs. 55 %). Cytokine Release Sydrom (CRS)-Ereignisse waren unter Tarlatamab vorwiegend vom Grad 1 (42%) oder 2 (13%), mit 1 % Grad-3-Ereignissen und keinem Auftreten von Grad 4 oder 5 Events. Immune-Effector-Cell-Associated Neurotoxicity Syndrome (ICANS) wurde bei 6 % der mit Tarlatamab behandelten Patient:innen beobachtet, jeweils 3 % mit Ereignissen vom Grad 1 bzw. Grad 2. Ein einzelner Fall eines Grad 5 ICANS wurde dokumentiert. Die am häufigsten auftretenden Nebenwirkungen im Tarlatamab-Arm waren, neben dem CRS, Dysgeusie, Pyrexie und verminderter Appetit.
Fazit
Die Ergebnisse der Studie zeigen, dass Tarlatamab in der Zweitlinie (Progress während/nach platin-basierter Chemotherapie) beim SCLC eine Therapieoption mit einem signifikant verlängerten Gesamtüberleben und weniger Grad ≥ 3 Nebenwirkungen vs. Chemotherapie darstellt. Mit der DeLLphi-304-Studie wird ein neues Behandlungsparadigma für bispezifische T-Zell-Engager in der Therapie des Lungenkarzinoms etabliert.
Sie können die Präsentation
hier downloaden.


