Am ASCO 2025 wurden erstmals Phase 3 Daten (DeLLphi-304) von Tarlatamab vs. Chemotherapie in der Zweitlinie des SCLC
präsentiert. Am ESMO 2025 konnten detaillierte Verträglichkeitsdaten zur DeLLphi-304 gezeigt werden sowie erste
Phase 1b Ergebnisse zu Tarlatamab in der Erstlinientherapie des ES-SCLC (DeLLphi-303).
Tarlatamab in der Zweitlinientherapie, Fokus: Verträglichkeit
“Detailed safety analysis of DeLLphi-304: The first phase III study to evaluate
tarlatamab versus chemotherapy for previously treated small cell lung cancer” – Schuler et al. LBA100
In der Phase 3 DeLLphi-304-Studie verbesserte Tarlatamab vs. Chemotherapie (CTx) in der Zweitlinie das
Gesamtüberleben signifikant mit einer HR von 0,60 (95 %-CI: 0,47–0,77). Patient:innen (n=509) wurden entweder mit
Chemotherapie (Topotecan, Lurbinectedin oder Amrubicin) oder Tarlatamab behandelt, und für 6-8 Stunden ambulant oder
48 Stunden nach der Behandlung stationär überwacht.
In dieser am ESMO gezeigten Analyse, lag der Fokus auf den Verträglichkeitsdaten der DeLLphi-304.
Ergebnisse:
Verträglichkeit :
Höhergradige (Grad ≥3) TRAEs reduzierten sich über die Dauer der Tarlatamab-Behandlung (Monat <1: 17%, Monat 1-3:
9%, Monat ≥ 3: 12%), während die Behandlung mit Chemotherapie durchgehend zu höhergradigen TRAEs führte (Monat
<1: 40%, Monat 1-3: 39%, Monat ≥ 3: 50%).
Das häufigste TRAE in der Tarlatamab-Gruppe war CRS (56%), das hauptsächlich im ersten Behandlungszyklus und
vorwiegend im Grad 1 oder 2 auftrat. Hämatologische Toxizitäten, wie z.B. Anämien (CTx: 37-51%; Tarlatamab: 7-11%),
Leukopenien (CTx: 11-18%; Tarlatamab: 2-5%), Neutropenien (CTx: 18-21%; Tarlatamab: 4-6%) und Thrombozytopenien
(CTx: 10-17%; Tarlatamab: 0-3%), traten häufiger unter Chemotherapie auf und blieben über die Dauer der Behandlung
bestehen (Abbildung 1).
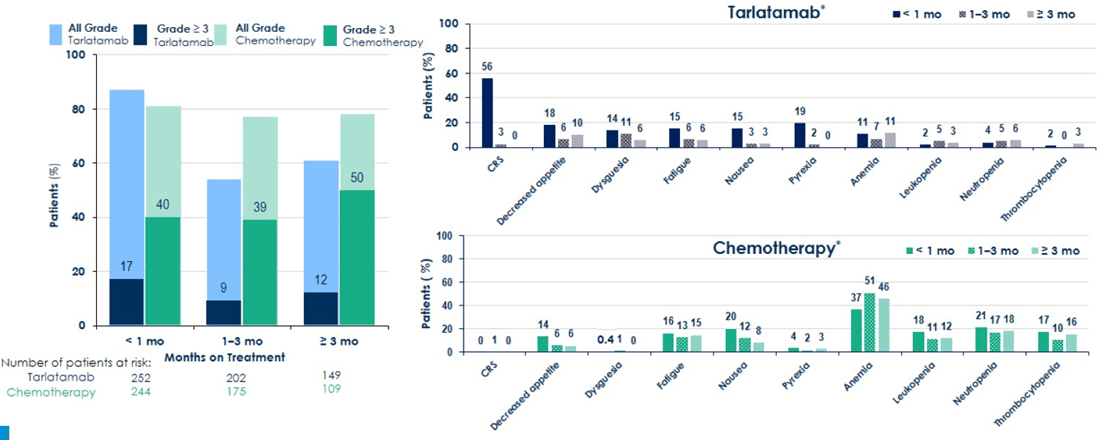
Abbildung 1: Häufigkeit und Schweregrad der
behandlungsassoziierten unerwünschten Nebenwirkungen über den Behandlungszeitraum.
Die Häufigkeit der Hospitalisierung nach Auftreten von CRS (alle Grade) war vergleichbar zwischen den 6-8 Stunden
(n=43; 7%) und 48 Stunden (n=209; 8%) Monitoringkohorten. Eine deskriptive Subgruppenanalyse konnte keine für CRS
prädiktive Patient:innenpopulation herausarbeiten (z.B. ECOG PS 0 vs. 1-2: 53% vs. 58%, Alter <70 vs. ≥ 70: 55%
vs. 61%, Lebermetastasen ja vs. nein: 63% vs. 53%, Hirnmetastasen ja vs. nein: 57% vs. 56%, Tumorgröße ≥ 72mm vs.
< 72mm: 62% vs. 51%).
Nach Behandlung mit Tarlatamab waren ICANS Ereignisse selten (6%) und vorwiegend vom Grad 1-2, mit den häufigsten
Symptomen einer Bewusstseinstrübung, Verwirrung oder Dysgraphie. Neurologische TRAEs (alle Grade) traten bei 45% der
Patient:innen auf, mit Dysgeusie als häufigstes Symptom (23%; Grad 1/2: 74%/26%). Dysgeusie wurde im Median nach 28
Tagen diagnostiziert und führte zu keinen behandlungsassoziierten Therapieabbrüchen.
Fazit:
In der DeLLphi-304-Studie zeigte Tarlatamab eine gute Verträglichkeit im Vergleich zu Chemotherapie als
Zweitlinienbehandlung von SCLC. Es wurden keine neuen Unverträglichkeiten in dieser Studie gefunden.
Die Slides könnnen Sie
hier herunterladen.
Tarlatamab in der Erstlinientherapie (Induktion & Erhaltung)
“Tarlatamab with first-line chemoimmunotherapy for extensive stage small cell
lung cancer (ES-SCLC): DeLLphi-303 study” – Wermke et al. 2757O
In dieser Phase 1b Studie (n=96) wurden Verträglichkeit und Wirksamkeit von Tarlatamab in Kombination mit 1L
Chemoimmuntherapie in der Induktions- und Erhaltungstherapie untersucht.
Patient:innen erhielten vor dem Studieneinschluss einen Zyklus Chemoimmuntherapie (Etoposid, Platin, Atezolizumab
oder Durvalumab). Im Rahmen der Studie wurden drei Zyklen Tarlatamab (20mg i.v.) in Kombination mit
Chemoimmuntherapie als Induktionstherapie (Q3W) verabreicht, gefolgt von Tarlatamab (20mg i.v.) in Kombination mit
Anti-PD-L1 als Erhaltungstherapie (Atezolizumab oder Durvalumab, Q3W) bis zum Progress.
Ergebnisse:
Wirksamkeit:
Bei einem medianen Follow-up von 13,8 Monaten, zeigten 71% der Patient:innen ein Ansprechen auf eine
Erstlinienbehandlung mit Tarlatamab in Kombination mit Chemoimmuntherapie, mit einer medianen Dauer (mDOR) von 11
Monaten und einem mPFS von 10,3 Monaten. Das geschätzte Gesamtüberleben lag nach 12 Monaten bei ~81% (Abbildung 2).
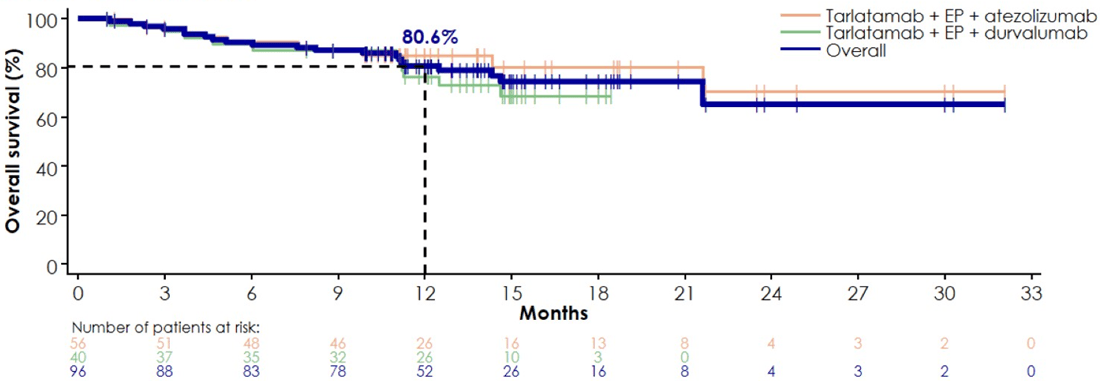
Abbildung 2: Gesamtüberleben bei 1L Tarlatamab in
Kombination mit Chemoimmuntherapie.
Zum Zeitpunkt der Analyse wiesen 49% der Patient:innen ein anhaltendes Ansprechen auf.
Verträglichkeit:
Von 96 eingeschlossenen Patient:innen zeigten 3% dosislimitierende Toxizitäten (ICANS n=1, Abnahme der
Thrombozytenzahl n=1, Thrombozytopenie n=1) und 100% behandlungsassoziierte Nebenwirkungen. Generell traten die
meisten behandlungsassoziierten Nebenwirkungen während der Chemoimmuntherapie in den ersten 3 Zyklen auf. Die
häufigsten Nebenwirkungen waren CRS (56%), Anämie (54%) und Dysgeusie (46%). CRS (Grad 1–2: 54%; Grad 3–4: 2%) sowie
ICANS (Grad 1–2: 5%; Grad 3: 1%) waren überwiegend niedriggradig. Höhergradige Nebenwirkungen (Grad ≥ 3) wie
Neutropenie (44%), Anämie (23%) und Lymphopenie (11%) traten bei 75% der Patient:innen vor allem in den ersten
beiden Zyklen auf. Das Verträglichkeitsprofil war konsistent mit jenem der Einzelsubstanzen.
Fazit:
Die Erstlinientherapie von ES-SCLC mit Tarlatamab in Kombination mit Chemoimmuntherapie zeigte eine kontrollierbare
Verträglichkeit und vielversprechende erste Überlebensdaten. Dies unterstützt die weitere Untersuchung dieser
Kombination in der Phase 3 Studie DeLLphi-312.
Die Slides könnnen Sie
hier herunterladen.
CRS: Cytokine Release Syndrome; ICANS: Immune Effector Cell-Associated Neurotoxicity Syndrome



