STEAP-1 ein neues Target beim mCRPC
Beim ESMO wurde die Interimsanalyse der First-In-Human-Studie zum Einsatz von Xaluritamig bei Patienten mit kastrationsresistentem Prostatakarzinom präsentiert.
Interim results from a phase I study of AMG 509 (Xaluritamig), a STEAP1 x CD3 XmAb 2+1 immune therapy, in patients with metastatic castration-resistant prostate cancer (mCRPC) – Kelly et al. (1765O)
Xaluritamig ist ein XmAb® 2+1 T-Cell-Engager mit zwei STEAP1- und einer CD3-Bindungsstelle, der die T-Zell-vermittelte Lyse von STEAP1-exprimierenden Zellen ermöglichen soll. STEAP1 ist ein Oberflächenantigen, das beim Prostatakarzinom stark exprimiert wird und mit einer schlechteren Überlebensprognose assoziiert ist.
In den Part 1 der Studie (Dose-Exploration) wurden insgesamt 97 Patienten eingeschlossen, die auf 15 verschiedene Dosislevel aufgeteilt wurden. Diese unterschieden sich durch die maximale wöchentliche Dosis und die Anzahl der Step-Dosings zuvor (Abbildung 1).
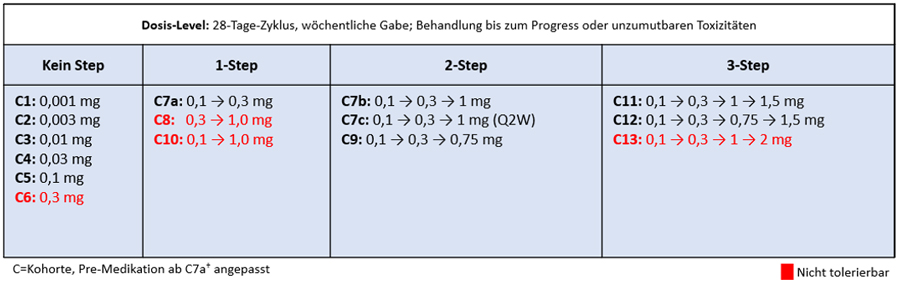
Abbildung 1 Schematische Darstellung der 15 Dosislevel
Ergebnisse:
Wirksamkeit
PSA50 konnte in 47,2% und PSA90 in 27% aller Patienten beobachtet werden. Dabei konnte in den höheren Dosisleveln häufiger ein PSA-Rückgang beobachtet werden (Tabelle 1).
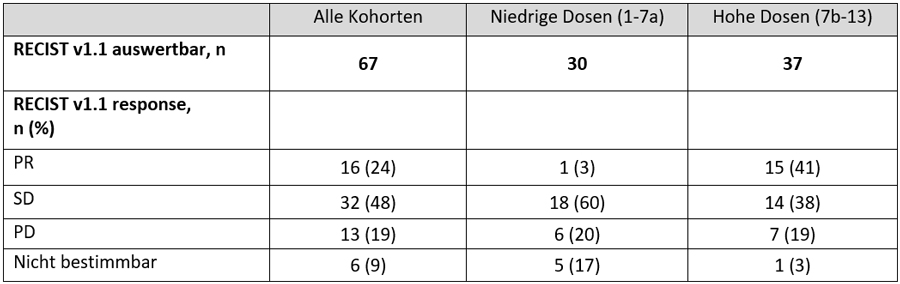
Von den nach Recist-Kriterien auswertbaren Patienten erreichten insgesamt 22,7% eine PR und 45,5% eine SD, wobei der Anteil an Respondern mit 38,9% vs. 3,3% in den höheren Dosisleveln größer war (Tabelle 2).
Tabelle 1 PSA response

Tabelle 2 Auswertung des Ansprechens nach Recist1.1
Verträglichkeit
TEAEs wurden in 100% der Patienten beobachtet (davon 74,2% ≥ Grad 3) und TRAEs in 95,9% (52,6% ≥ Grad 3). Bei 17,5% der Patienten führten TRAEs zu einem Absetzen der Therapie.
Die häufigsten unerwünschten Ereignisse waren CRS (72,2%, vorwiegend Grad 1/2 und in den frühen Zyklen), Fatigue (52,6%) und Anämie (45,4%) (Abbildung 2).
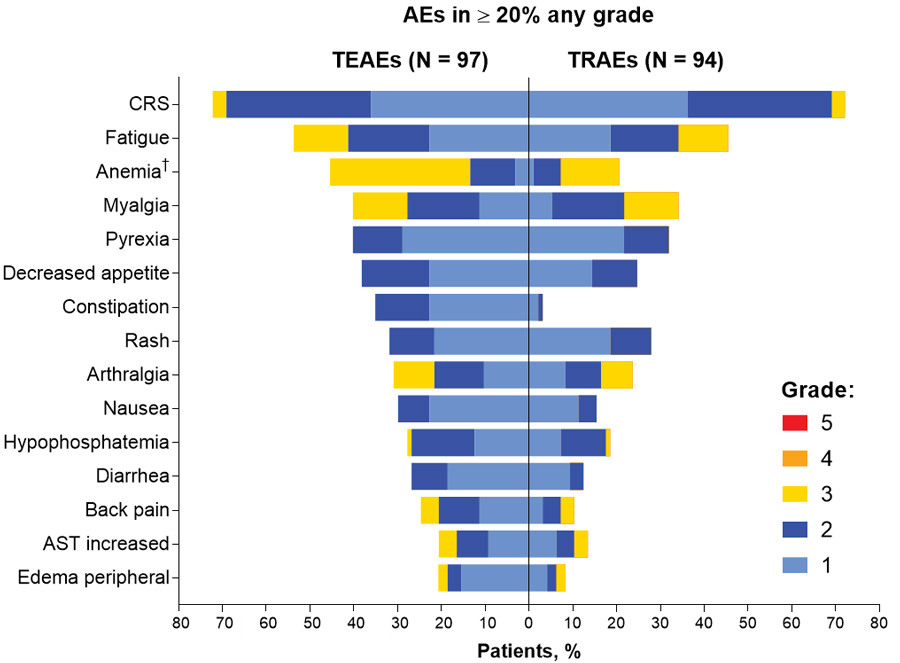
Abbildung 2 Übersicht über unerwünschte Ereignisse (AEs), die bei ≥20% aller Patienten aufgetreten sind
Fazit:
Die Autoren schlussfolgern, dass die Behandlung mit Xaluritamig tolerierbar ist und erste vielversprechende Ergebnisse bei stark-vorbehandelten Patienten mit mCRPC zeigte.
Die MTD für die Dose-Expansion-Phase wurde auf 1,5 mg i.v. pro Woche nach 3 Stepdosings in Zyklus 1 (0,1 mg, 0,3 mg, 1,0 mg) festegelegt.
Die Präsentation kann
hier heruntergeladen werden.





